-
通过体外诊断(IVD)或实验室开发测试(LDT)来选择您的路径
-
从开发到验证,充分利用多元化的生物标记物专业知识
-
获得明智的法规指导以及市场准入战略
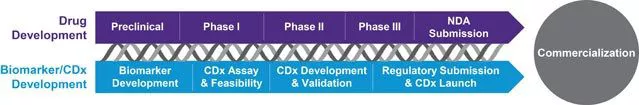
精准医疗需要患者分层——即识别更有可能获益于疗法的目标患者;伴随诊断也实现了研发时间和处方药研发成本的减少、形成更有利的报销模式,并可以展示比较效果。
被称为“辅助诊断”的一种全新方案提供了有关药物可能被如何使用的额外信息,但这与伴随诊断又有所不同。我们为最早获得FDA批准的两项辅助诊断的研发提供了支持,因此可以帮助您权衡各个战略方案。
您的治疗法需要搭档;您也需要资源丰富的合作伙伴。
伴随诊断可让个体化用药的承诺成为现实。凭借我们来自各治疗领域的医疗和科学专家团队的支持,您将能协调您的处方药和诊断研发工作。通过疗法审批后,我们将帮助您将伴随诊断更快推向市场。
选择的力量:体外诊断或实验室开发的测试。
伴随诊断商业化的最佳路径可能不涉及传统的分布式体外诊断(IVD)试剂盒。涉及罕见病用药、时间紧张或操作复杂的项目可在通过FDA审批、基于实验室的检测方法推动下取得迅猛进展。您可将前期投资需求降至最低,并可降低与广泛分布式IVD试剂盒相关的潜在风险。作为您的合作伙伴,我们将开发并验证您的测试,促成法规文件递交并立即向全球市场进行发布,从而让您的测试更快上市。
无论是实验室开发测试 (LDT) 还是IVD,您都需要在专家的指导下,将伴随诊断和治疗研发相结合,从您的试验中获得最大价值。我们在临床试验领域拥有超过25年的经验,并已向市场推出超过80种诊断,我们具备必要的技术资源、战略灵活性和科学见解,能够帮助您确定实现商业化的最佳方案。
全球覆盖和稳定一致的伴随诊断验证。
伴随诊断研发具有针对性,这意味着检测方法需要针对各类患者群体进行设计并在各类患者群体中进行验证。您可在统一的中心实验室利用我们的全球覆盖率、分销网络和标准化效率。我们高水准的研究中心遍及全球各地,确保您每次都可获得优质、可合并的数据。
我们的伴随诊断解决方案,为您带来潜能。
我们的伴随诊断服务并非只是我们相关实力的列表清单,它们还能共同支持并加速联合开发的各方面工作。经验无可取代:约25种FDA批准或认可的伴随诊断设备中有19种得到了我们的支持,其中包括针对HER-2、KRAS、EGFR、BRAF和ALK的设备。借助一个战略合作伙伴统一您对伴随诊断的追求,包括:
- 生物标记物识别与开发
- 检测方法可行性、概念验证和验证
- 全球临床试验测试
- 设备生产和商业化合作
- 上市前审批(PMA)申请和提交
- 市场准入策略、发布支持和商业化指导
凭借在肿瘤学和免疫肿瘤学、中枢神经系统、传染病和炎症的伴随诊断和辅助诊断方面的丰富经验,对相关科学技术的精通以及重点明确的专业知识,我们可推动您的伴随诊断取得成功。